Beaucoup d’acteurs du monde médical et des médias s’insurgent contre ce qu’ils appellent « la mode du sans gluten ».
A côté des patients objectivement diagnostiqués « cœliaques », qui constituent aujourd’hui entre 0,5 et 1% de la population, les personnes touchées par une « hypersensibilité non-cœliaque au gluten » sont souvent taxées de malades imaginaires car cette hypersensibilité est encore difficile à objectiver par les tests sanguins classiques.
Et pourtant, un nombre croissant de personnes choisissent de bannir le gluten de leur alimentation et affirment s’en porter beaucoup mieux ! Pourquoi mettre leur parole en doute ?
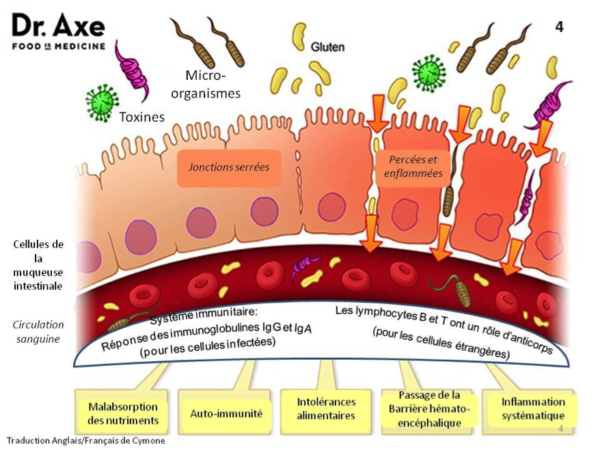
Les travaux de Fasano (Fasano 2011, Hollon et al. 2015) apportent un éclairage scientifique précis au sujet des effets de la consommation de gluten. Ces études récentes mettent concrètement en lumière l’agression chronique de l’intestin induite par la consommation de gluten et l’hyperperméabilité de la barrière intestinale qu’elle induit, pas seulement chez les malades cœliaques, mais chez tout consommateur.
Ces découvertes méritent d’être soulignées car il est largement admis que l’hyperperméabilité intestinale fait le lit de nombreuses pathologies chroniques et inflammatoires.
La fonction de perméabilité sélective de la barrière intestinale
La muqueuse intestinale, qui représente une surface de plus de 300 m², doit à la fois permettre l’assimilation de l’eau, des vitamines et des nutriments nécessaires au bon fonctionnement de l’organisme et empêcher le passage des agents pathogènes, des toxines et des protéines alimentaires non digérées. Elle exerce donc une fonction de perméabilité sélective.
Les échanges au niveau de la barrière intestinale s’opèrent selon deux mécanismes principaux : la voie transcellulaire et la voie paracellulaire.
La voie transcellulaire
C’est la voie principale d’absorption des nutriments digérés (protéines, lipides, glucides). Ils traversent les cellules épithéliales de l’intestin dont les lysosomes finissent de dégrader les protéines immunologiquement actives en petits peptides inactifs. Ils rejoignent ensuite les circulations sanguine ou lymphatique. La traversée des membranes se fait par transport passif (gradient de concentration) ou actif (nécessitant de l’ATP), avec l’aide ou non de protéines de transport spécifiques. Cette voie, connue de longue date, a longtemps été considérée comme la seule voie de passage possible pour ces nutriments.
La voie paracellulaire
Il existe un autre système permettant aux nutriments de traverser la barrière intestinale. Au lieu de traverser les cellules épithéliales, les nutriments les contournent en utilisant les passages intercellulaires régulés par les jonctions serrées. Dans certaines conditions bien précises, cette voie dite paracellulaire permet le passage d’eau et de petites molécules hydrophiles entre les jonctions serrées des cellules épithéliales.
Ces jonctions serrées doivent être dynamiques et capables de produire des réponses rapides et coordonnées en fonction des besoins et contraintes exercées sur la paroi intestinale. De ce fait, elles sont soumises à un système de régulation complexe qui orchestre le degré d’assemblage du réseau de protéines transmembranaires. Lorsque ce système fonctionne de manière physiologique, il assure l’étanchéité de la barrière intestinale et empêche les grosses molécules, les corps étrangers et les polluants de l’environnement de rejoindre la circulation sanguine.
ROLES ET FONCTIONNEMENT DE LA ZONULINE
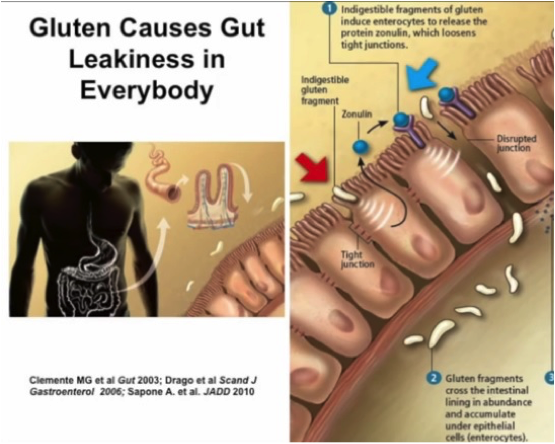
Le système de régulation complexe de la voie paracellulaire repose sur une protéine endogène fabriquée par la muqueuse intestinale: la zonuline.
Cette protéine a été identifiée par les chercheurs comme étant la pré-haptoglobine-2 ou HP-2. Elle était jusque-là considérée comme inactive avec pour seule fonction de former des complexes HP-Hb (Hémoglobine) stables afin de protéger les tissus des dommages oxydatifs induits par l’hémoglobine.
Or, les études récentes montrent que c’est loin d’être son unique rôle. La zonuline peut être considérée comme une véritable hormone. Son rôle physiologique exact n’est pas complètement élucidé, mais on sait qu’elle est impliquée dans l’ouverture ponctuelle des jonctions serrées pour faciliter le mouvement des fluides, de certaines macromolécules et des leucocytes du sang vers la lumière intestinale et inversément. Elle interviendrait notamment pour nous protéger d’une colonisation bactérienne massive en cas de gastro-entérite.
Les perturbateurs de la zonuline
Le système de régulation des jonctions serrées est un processus très sophistiqué qui peut facilement se dérégler. Certains facteurs sont en effet capables de perturber la sécrétion ou l’activité de la zonuline et, par conséquent, d’augmenter anormalement la perméabilité intestinale.
Parmi le très grand nombre de stimuli potentiels pouvant induire une hypersécrétion de zonuline, les chercheurs en ont identifié deux principaux : les bactéries entéro-toxiques et le gluten.
Les bactéries
Les chercheurs ont montré que l’exposition de l’intestin grêle à des bactéries entéro-toxiques provoque la sécrétion de zonuline, et ce, quelle que soit l’espèce animale hôte utilisée ou la virulence du micro-organisme testé. Cette sécrétion de zonuline a pour but de faciliter le mouvement des fluides et des leucocytes pour augmenter l’efficacité de la réponse immunitaire face à l’agression.
Le gluten
Le gluten est une molécule composée de deux protéines, la gliadine et la gluténine.
Les chercheurs ont identifié un récepteur à la gliadine au niveau des cellules épithéliales de l’intestin baptisé « CXCR3 ». L’interaction de la gliadine avec son récepteur provoque la libération de zonuline qui, à son tour, provoque la déstructuration du cytosquelette d’actine des jonctions serrées. La liaison de la gliadine à son récepteur augmente donc la perméabilité intestinale.
Les études montrent que le CXCR3 est nettement surexprimé chez les patients atteint de maladie coeliaque. Il existe donc clairement un polymorphisme génétique prédisposant à la maladie coeliaque.
Cependant, l’hypersécrétion de zonuline n’est pas le seul mécanisme délétère lié à la consommation de gluten.
Les chercheurs ont décortiqué la molécule de gluten et ont identifié plusieurs fragments peptidiques responsables d’effets délétères divers, se renforçant les uns les autres. Ils ont ainsi identifié :
- le peptide 31 à 43, cytotoxique
- le peptide 57 à 89, très allergisant et immunostimulant. Ce peptide est en effet résistant à la dégradation par l’acidité de l’estomac, par les enzymes pancréatiques et par les peptidases de l’intestin grêle. Il parvient aux tissus lymphoïdes de l’intestin quasiment intact, entraînant une susceptibilité importante de provoquer une réponse immunitaire
- les peptides 111 à 130 et 151 à 170 qui se lient au récepteur CXCR3 et stimulent la libération de la zonuline, responsable de l’augmentation de la perméabilité intestinale
- le peptide 261 à 277 qui induit la libération d’interleukine 8, cytokine pro-inflammatoire impliquée de manière importante dans les maladies chroniques inflammatoires de l’intestin telles que maladie de Crohn ou la rectocolite hémorragique.
La problématique du gluten se trouve amplifiée par la place de plus en plus prépondérante qu’occupent les céréales dans notre régime alimentaire depuis 5 000 ans, délai qui ne représente rien à l’échelle de l’humanité mais qui n’a pas laissé le temps à nos systèmes enzymatiques de s’adapter suffisamment pour nous permettre de digérer de manière optimale toutes les protéines contenues dans ces céréales. En outre, les hybridations et autres manipulations du blé et du froment modernes ont rendu ces aliments de plus en plus riches en gluten et en éléments étrangers à nos enzymes et tubes digestifs.
AUTRES Facteurs de perméabilité INTESTINALE
Bien que la consommation de gluten soit particulièrement délétère pour l’intégrité de la barrière intestinale, il existe d’autres facteurs pouvant compromettre ou aggraver l’intégrité des jonctions serrées.
On sait notamment que l’intestin immature des bébés prématurés, celui de personnes soumises à une radio- ou à une chimiothérapie, où celui des sportifs de haut niveau est anormalement perméable.
Il est également probable que certains produits chimiques environnementaux comme les perturbateurs endocriniens et les pesticides jouent un rôle non négligeable dans la perturbation de l’activité de la zonuline.
De nombreux autres aliments, substances chimiques ou facteurs sont également probablement impliqués. On peut citer notamment la caséine (qui constitue 80 % des protéines du lait et des produits laitiers), les solanacées (pommes de terre, les piments, la tomate,…), les médicaments anti-inflammatoires non stéroïdiens (aspirine, ibuprofène, …), les déficits en zinc et en vitamine D (qui touchent plus de 75% de la population).
Perméabilité intestinale et maladies chroniques
Maladie Coeliaque
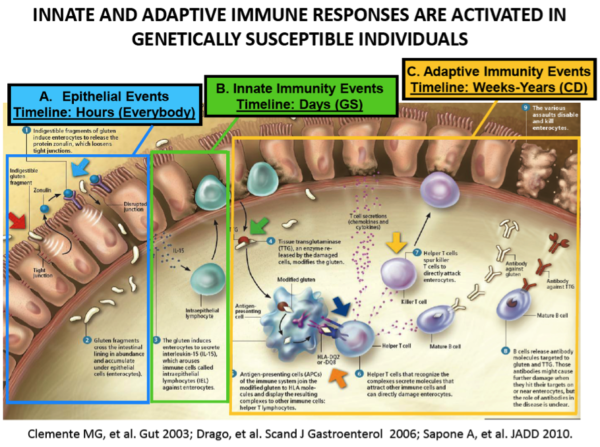
Pour expliquer le développement de la maladie coeliaque, les chercheurs émettent l’hypothèse suivante :
- Après ingestion orale, la gliadine interagit avec la muqueuse du petit intestin provoquant la libération d’interleukine 8 par les entérocytes (peptide 261 à 277), conduisant immédiatement au recrutement des neutrophiles (cellules du système immunitaire) de la paroi intestinale.
- En même temps, les deux peptides qui augmentent la perméabilité intestinale (111 à 130 et 151 à 170) provoquent la libération de zonuline.
- Le désassemblage des jonctions serrées permet le passage de la gliadine par la voie para-cellulaire. En conséquence la gliadine est reconnue par les macrophages de la sous muqueuse intestinale comme étant un antigène toxique. Cette interaction gliadine/macrophage initie la voie de signalisation qui conduit à la mise en place d’un terrain pro-inflammatoire avec infiltration de cellules mononucléaires dans la sous-muqueuse.
- La brèche initiale induite par la zonuline s’auto-entretient ensuite par ce processus inflammatoire, entraînant la lésion des villosités intestinales. La situation se normalise lorsque les patients passent à un régime sans gluten : les cytokines pro-inflammatoires et les taux sériques de zonuline diminuent, la barrière intestinale se reconstitue, les anticorps auto-immuns se normalisent et les dommages intestinaux s’arrêtent.
Par ailleurs, la maladie coeliaque est la seule maladie auto-immune pour laquelle il existe une corrélation directe entre 3 éléments bien identifiables : un gène HLA (le phénotype HP2-1 hétérozygote avec surexpression du récepteur CXCR3 prédispose particulièrement à la maladie), une réponse auto-immune humorale spécifique dirigée contre la transglutaminase tissulaire et un facteur environnemental bien défini: la gliadine du gluten.
C’est la conjonction de ces 3 facteurs qui conduit au développement de la maladie. Dans des circonstances physiologiques normales où les jonctions serrées conservent leur intégrité et jouent correctement leur rôle de barrière sélective, la gliadine ne s’infiltre pas par la voie paracellulaire et n’entraîne pas de réponse immunitaire anormale contre la transglutaminase, empêchant ainsi les lésions tissulaires.
Autres maladies chroniques inflammatoires
Outre la maladie cœliaque, de plus en plus de maladies sont reconnues comme directement liées aux altérations de l’étanchéité de la paroi intestinale.
Parmi elles, on retrouve les maladies auto-immunes comme le diabète de type I, le sclérose en plaque ou encore la polyarthrite rhumatoïde. Dans ces pathologies, les jonctions serrées laissent passer des antigènes en provenance du milieu intestinal qui activent anormalement le système immunitaire. Il produit des anticorps dirigés contre ces antigènes qui peuvent également cibler certains tissus ou organes du corps selon les prédispositions génétiques de chacun.
L’hyperperméabilité intestinale est également impliquée dans le développement des cancers, des infections et des allergies (notamment l’asthme).
Il est généralement admis que c’est la conjonction des facteurs environnementaux et des prédispositions génétiques de chacun (notamment via le système HLA) qui est à l’origine de cette réponse immunitaire aberrante et qui conduit à l’une ou l’autre de ces maladies. Pourtant, toute pathologie confondue, seules 10% des personnes présentant un facteur de risque génétique développent effectivement la maladie, ce qui prouve que les facteurs environnementaux restent prépondérants.
Ces maladies peuvent être freinées ou prévenues par la restauration de la perméabilité de la barrière intestinale. Dans cette optique, en plus des protocoles nutrithérapeutiques de restauration de la barrière intestinale (glutamine, Zinc, vitamine D, oméga-3, pré et pro-biotiques, …), l’éviction du gluten de l’alimentation des personnes atteintes de maladies auto-immunes ou inflammatoires chroniques (ou à risque de l’être) apparaît comme une évidence au regard du principe de précaution.
Des traitements anti-zonuline en cours d’expérimentation
Des expérimentations prometteuses recourant à un inhibiteur de la zonuline ont été effectuées sur des rats diabétiques. L’administration chez ces rats d’un prétraitement avec un inhibiteur de la zonuline a permis d’empêcher la perte d’étanchéité intestinale et de prévenir l’apparition des anticorps auto-immuns menant à la destruction les îlots de Langerhans du pancréas.
Dans le même ordre d’idées, une étude randomisée en double aveugle contre placebo a été effectuée chez des patients atteints de maladie coeliaque afin de déterminer la tolérance, la sécurité et l’efficacité d’un traitement inhibiteur de la zonuline. Après une exposition aiguë au gluten, une augmentation de 70 % de la perméabilité intestinale a été observée dans le groupe placebo alors que l’étanchéité de la barrière intestinale du groupe soumis au traitement inhibiteur de la zonuline n’a subi aucune dégradation. Par ailleurs, le traitement anti-zonuline a été bien toléré.
Ce traitement constitue donc un espoir important non seulement pour les malades coeliaques mais également pour les personnes atteintes d’allergies et de maladies auto-immunes diverses.
Hélène Wacquier
Sources et références
- Vanuytsel, T; et al. (Dec 2013). “The role of Haptoglobin and its related protein, Zonulin, in inflammatory bowel disease”. Tissue Barriers. 1 (5): 27321. doi:10.4161/tisb.27321. PMID 24868498.
- Fasano, A (Jan 2011). “Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer”. Physiol Rev. 91 (1): 151–75. doi:10.1152/physrev.00003.2008. PMID 21248165.
- Lammers, Karen M.; Lu, Ruliang; Brownley, Julie; Lu, Bao; Gerard, Craig; Thomas, Karen; Rallabhandi, Prasad; Shea-Donohue, Terez; Tamiz, Amir (Jul 2008). “Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3”. Gastroenterology. 135 (1): 194–204.e3. doi:10.1053/j.gastro.2008.03.023. ISSN 1528-0012. PMC 2653457. PMID 18485912.
- Visser, Jeroen; Rozing, Jan; Sapone, Anna; Lammers, Karen; Fasano, Alessio (May 2009). “Tight Junctions, Intestinal Permeability, and Autoimmunity Celiac Disease and Type 1 Diabetes Paradigms”. Annals of the New York Academy of Sciences. 1165: 195–205. doi:10.1111/j.1749-6632.2009.04037.x. ISSN 0077-8923. PMC 2886850. PMID 19538307.
- Fasano, Alessio (Jan 2011). “Zonulin and Its Regulation of Intestinal Barrier Function: The Biological Door to Inflammation, Autoimmunity, and Cancer”. Physiological Reviews. 91 (1): 151–175. doi:10.1152/physrev.00003.2008. ISSN 0031-9333. PMID 21248165.
- Lemmer, HJ; Hamman, JH (Jan 2013). “Paracellular drug absorption enhancement through tight junction modulation”. Expert Opin Drug Deliv. 10 (1): 103–14. doi:10.1517/17425247.2013.745509. PMID 23163247.
- Alba Therapeutics announces positive results of phase IIb trial in celiac disease” (Press release). Alba Therapeutics. February 11, 2014.
- Hollon J, Puppa EL, Greenwald B, Goldberg E, Guerrerio A, Fasano A (Fev 2015). Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with non-celiac gluten sensitivity. Nutrients. 2015 Feb 27;7(3):1565-76.
- Debon A (Juin 2015), Allergie au Gluten et Zonuline, Url: http://www.dietetique-lyon.fr/allergie-au-gluten-la-zonuline-mise-en-cause/


